【JACS】颠覆性“2步解锁”!让光控药物只在目标处释放的化学逻辑

引言
在精准治疗与光学操控的交叉领域,**“光控药物释放”**长期被视为一种极具吸引力的技术路线:通过光将药物从“笼”中释放出来,既能做到时间可控,又能实现空间定位,从而降低系统性毒副作用。不过现实里,光控策略面临两个根本挑战:一是光本身对组织的穿透能力有限(紫外与短波蓝光更难深入组织),二是“光一照即开”这个特性在复杂体内环境中容易导致非靶向激活,风险不可忽视。
因此,如何在保留光控时空精度的同时,再增加一层生物学或化学选择性,成为研究热点。最近发表在《Journal of the American Chemical Society》的一项工作提出了颇有创造力的解决方案:将光敏分子“伪装”(camouflage)起来,使其在未经化学触发前对光完全“免疫”,而只有在生物正交反应触发后,分子恢复对可见光(本研究用绿光)敏感,从而实现“化学触发 + 光照激活”的双重、顺序控制(即逻辑“AND”门)。这项工作不仅在分子设计上巧妙,还把光控药物释放的安全性向前推进了一大步。接下来我会把这篇论文的核心方法、关键实验与结果用通俗的语言拆开讲清楚,并对它的意义与未来应用做出评估。文中关键数据与方法均直接源自论文实验(见文末参考)。
研究方法解读
要理解这篇论文的方法,先得把两件“工具”弄清楚:一种是Rhodol 型光笼(photocage)分子的可逆色态/反应行为,另一种是生物正交的 click-to-release(c2r)反应,也就是 TCO — tetrazine 的“化学钥匙”。
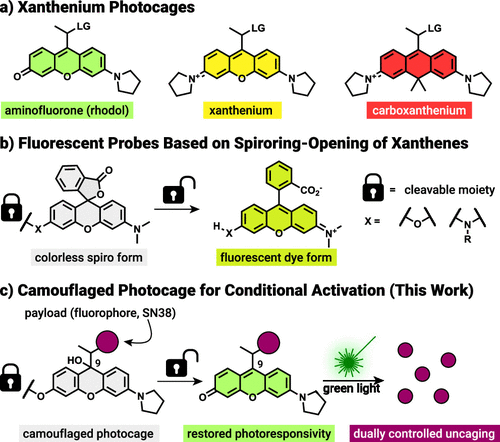
1)Rhodol 光笼的“伪装”原理:颜色等于能不要光敏
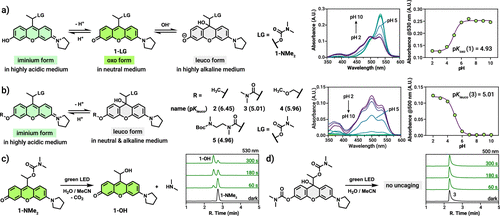
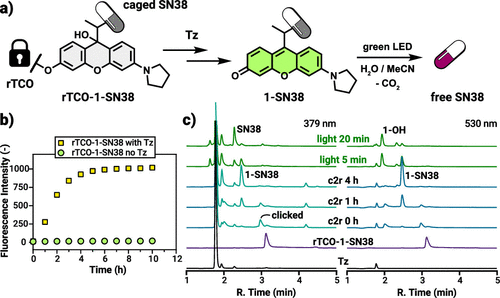
Rhodol(氨基荧光酮)属于黄酮/黄烷类到 xanthenium 家族的一类染料,它们的成像与光敏能力取决于分子的共轭体系是否完整。Ember 等人注意到,Rhodol 在不同化学状态下存在三种互变体:可吸光并光敏的 oxo(有色)形态,酸性下的 iminium(阳离子)形态,以及完全无色、对光不响应的 leuco(还原/加成)形态。关键发现是:只要在 氧(O)辅色基团处做一个简单的取代(如形成碳酸酯或醚键),就能把平衡极大地偏向 leuco 形态——也就是给光笼套上“隐身斗篷”,让它即便被绿光照射也不会解笼。
作者通过系统合成并对比了几种 O-取代的模型化合物,借助 pH 依赖性的紫外-可见(UV/vis)吸收谱,量化了各体系在生理 pH(7.4)下的形态分布(论文中以 pK_leuco 或 pK_oxo 表示平衡点)。结果显示,O-碳酸酯衍生物在 pH 7.4 下几乎 99.6% 以 leuco 形态存在,因此对光“钝化”得非常彻底:相同光强和照射条件下,有色的 parent 光笼会快速发生 photosolvolysis(释放负载),而 O-取代的“伪装”体根本不发生光触发的解笼反应(HPLC-MS 与 1H NMR 均确认)。这一发现为双重控制策略奠定了分子基础:在“伪装”状态,单独的光照无法误触发药物释放。
2)生物正交 click-to-release:用化学钥匙解除伪装
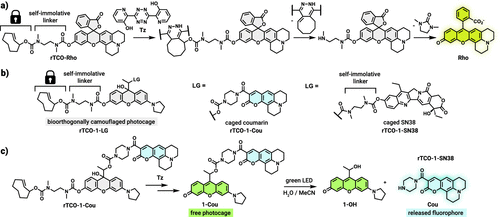
要把“伪装态”变回“可激活态”,需要一个在体内温和、专一且快速的化学触发反应。研究团队采用了反式环辛烯(TCO)连接到染料的 O 位(via 自我解离型连接子),并利用与 tetrazine(Tz) 的逆电子需求 Diels–Alder(IEDDA)反应作为“点击-释放(c2r)”机制。该反应在化学生物学界非常成熟:高选择性、快速且在生物体系中友好。
具体做法是:先将 rTCO(release-TCO)通过一个自我拆离(self-immolative)碳酸酯/氨基联结子连到 Rhodol 的氧位,得到“被伪装的光笼” rTCO-1-(payload)。在这种状态下,分子以 leuco 态存在、对光不敏感;一旦加入 tetrazine(可以是预先在靶区累积或被递送的试剂),IEDDA 发生,rTCO 被转化并脱离,随后自我拆链(self-immolation)释放出原先被阻断的氧位,使分子重建为有色的 oxo 形态,从而恢复对可见光(绿光)响应能力。
作者在方法学上还做了两点重要工作以确保可检测与可表征性:一是设计了以 Coumarin(Cou)为荧光“指示子”的 rTCO-1-Cou 体系,借助 FRET 抑制与荧光恢复能直观监测解锁与随后光照释放的整个链条;二是通过 UV/vis、荧光光谱与 HPLC–MS 的联用,追踪 click、释放(release)与 leuco→oxo 转变的时间学(kinetics),并确定各步的主导时间尺度与速率限制环节。
3)关键实验条件与评价指标
在溶液与细胞实验中,作者采用的条件与测量指标包括但不限于:在缓冲/混合溶剂体系中以 549 nm 绿光照射(72 mW 输出)来测试光敏解笼行为;使用 5 倍当量的 Tz 来触发 rTCO-1 的化学解锁;通过 UV/vis 监测 530 nm(oxo 形态特征吸收)峰的出现;用 HPLC–MS 识别中间体以及最终产物;在细胞层面采用 SK-OV-3(卵巢癌)细胞进行成像与细胞活力(MTT)评估。一个关键的时间尺度是 leuco→oxo 的半衰期(在中性条件下 τ1/2 ≈ 31 min),以及整个 click-to-release 与自我拆离过程通常在数小时内接近完成(论文中显示多在 1–6 小时范围,依条件而异)。这些时间学信息有助于判断该策略在体内/临床前场景的可行性。
研究结果分析
这部分我们把论文的核心发现拆开来讲,包括溶液化学行为、荧光示踪实验、以及细胞水平的功能性验证,并在适当位置把数据意义和与先前工作的比较讲清楚。
溶液层面:伪装彻底、解锁可行且可观测
作者合成了一系列模型化合物(编号 1–5),所有化合物都带有相同的离去基(dimethylamine)以便比较光学与解笼行为。未被取代的 parent(1-NMe2)在 pH 7.4 下几乎全部为 oxo 形态,绿光照射能快速释放离去基并生成可检测产物;相比之下,带 O-carbamate 或 O-ether 等取代基的 2–5 在相同条件下基本不发生光诱导解笼,HPLC-MS 与 NMR 未见 photosolvolysis 副产物。这说明 O-取代能把光敏性“关掉”——在分子水平上完成了对光的“伪装”。
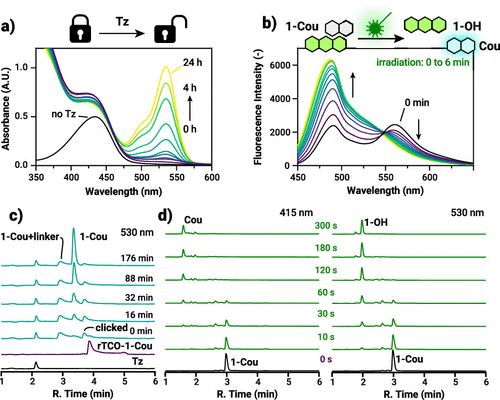
更进一步,作者用 rTCO-Rho(荧光示踪探针)证明:在加入 bis(3-hydroxypyridin-2-yl) tetrazine 等触发剂后,荧光信号在 1 小时内可增长约 40 倍,直接证实 click-to-release 的高效性。随后在 rTCO-1-Cou 中,tetrazine 触发后吸收谱出现 530 nm 峰(oxo 特征),并在随后绿光照射 6 分钟内释放 Cou 荧光,充分证明“化学触发 → 分子显色 → 光触发解笼”这一连续流程是可控而且可监测的。
时间学与速率:哪些步骤耗时、哪些是迅速的?
论文用 UV/vis 与 HPLC–MS 分段追踪了整个级联:点击(IEDDA)几乎瞬时完成,而后续的自我拆离(self-immolation)与 leuco→oxo 的平衡转换主导了整体时间尺度。在中性缓冲体系中,leuco→oxo 的 τ1/2 约为 31 分钟,整个释放路径在数小时内趋于完成。作者指出,在他们的体系中 IEDDA 并非限速步骤,限速环节更可能是化学释放、自我拆离或 leuco→oxo 的热力学/动力学转换。因此,如果要提高整个体系响应速度,应从改进自我拆离链节或优化 leuco→oxo 转换速率入手。
细胞层面:选择性与生物活性恢复
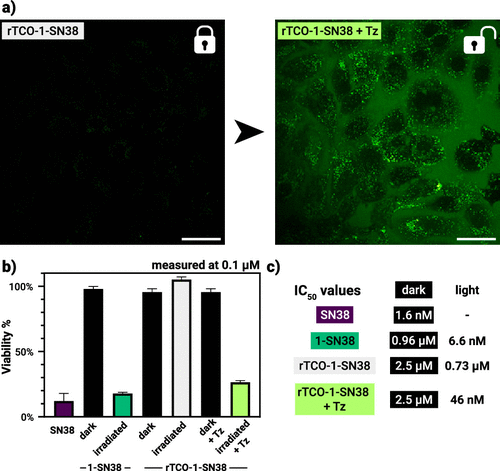
最令人关注的是作者把该策略应用到药物前体 rTCO-1-SN38(SN38 是伊立替康的活性代谢物,毒性强但作用强)。在 McCoy’s 5A 培养基和 37 ℃ 条件下,加入 tetrazine 后,体系在数小时内显示出 1-SN38 的形成(通过 LC-MS 与荧光表征),随后绿光照射可进一步释放活性 SN38。
在 SK-OV-3 细胞实验中,研究者把对照设置得很清楚:单独 SN38、单独光、单独 Tz、以及 Tz+光等组合都做了对比。关键结果是:rTCO-1-SN38 在“无触发”或“仅光照”的条件下对细胞无明显毒性;而在“先给 Tz,再照绿光”的条件下,细胞活性明显下降(MTT 结果显示细胞存活率显著下降,IC₅₀ 也大幅降低至近纳摩尔量级)。这就证明了在细胞水平该体系实现了“双重控制释放”——既需要化学钥匙解除伪装,也需要光触发释放活性分子。论文还通过共定位成像显示,这些前药和已激活的产物在细胞内的分布(溶酶体富集现象)与体系的 pH 依赖性相一致。
与之前工作的比较:优势何在?
过去关于条件光激活的研究通常采用两条路线:一是把光敏基团的激发被“直接四嗪淬灭”——四嗪本身吸收并抑制发光,从而需要 tetrazine 消失后光才有效;二是用酶切或其他生物可切除的“猝灭基”来控制光敏性。但这些策略或受限于波段(多数依赖紫外/蓝光)或受限于四嗪本身对长波段染料的限制(四嗪吸收会影响设计)。Ember 小组的创新在于:不是靠四嗪“直接淬灭”染料,而是把“伪装”基团直接连到氧位上,使分子进入 leuco(无色)态,从而把光吸收通道彻底阻断。这一步把条件光激活的适用范围拓展到了吸收更长波长(更生物友好)的染料家族,并且把“触发-再激活”的逻辑做得更为通用与可移植。
局限性与现实障碍
尽管上述结果相当鼓舞人心,但论文也诚实地指出当前方法的局限:整个化学触发与自我拆离到 leuco→oxo 恢复的时间尺度仍以小时计(尽管 IEDDA 非常快,但后续步骤耗时),这对于临床即时激活(需在数分钟内完成)并非理想。此外,体内递送 tetrazine 或如何把 Tz 局部化到病灶仍是需要工程化解决的关键问题。作者提到,近期生物正交释放化学的新进展已能实现分钟级的释放,这为系统实际转化提供了可能,但还需更多工作使整套系统在体内表现稳定与高效。
讨论与展望
这项研究把“分子伪装 + 化学解锁 + 光触发”这套链条清晰地构建并在细胞水平验证,代表了一种从概念到可操作性较强的进阶式光控策略。短期内,这样的二级控制可最先应用于组织可达的浅表肿瘤光化疗、术中局部激活药物、或与光纤联合的局部精确给药场景。在这些应用里,研究者可以把 tetrazine 通过前靶向抗体、局部输注或微环境诱导的释放方式聚集在病灶,再由光进行二次精密触发,从而把毒性限制在“既在组织内又在病灶内”的双重条件下。
从长期与更广阔的角度看,最令人期待的是把“伪装-解锁-触发”这套机制做成可程序化的分子逻辑元件:一个分子可以被设计为对多种生物信号(如 pH、酶、氧化还原状态)做条件判断,再结合不同波段的光做最终释放,从而实现高度个性化的“条件药物”。此外,若能与快速释放的生物正交化学(分钟级)结合,并改进自我拆离链节以缩短释放时间,未来在体内精确药物释放、可控基因编辑(如条件性激活核酸编辑剂)以及智能成像探针等方面都具有显著潜力。
当然,转向临床还需解决一系列问题:体系在体内的稳定性与免疫原性、用于触发的 tetrazine 或 TCO 标记的递送策略、光源在组织深处的可达性(或采用近红外/两光子激发技术)、以及大规模可制造性与毒性评估等。论文对此保持谨慎并给出未来改进方向,显示出科学家的务实态度。
总结
这项“2步解锁”策略通过化学伪装和生物正交解锁,让光控药物具备真正的“双重判断”能力,显著提高释放的空间与生物学选择性,是实现更安全、可编程分子治疗的重要迈进。
参考文献
Ember, O. et al. Double Disguise: Camouflaging Photocages for Bioorthogonally Controlled Conditional Activation. J. Am. Chem. Soc. jacs.5c15005 (2025) doi:10.1021/jacs.5c15005.